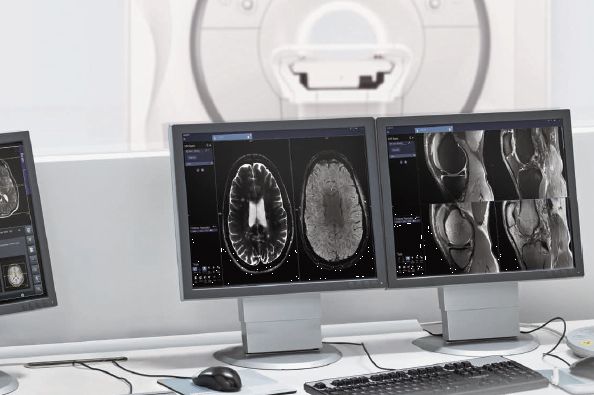
(Wien, 28-08-2017) Der 7-Tesla-Magnetresonanztomograph (MRT) Magnetom Terra von Siemens Healthineers hat die CE-Zulassung erhalten: Magnetom Terra ist damit der erste klinisch zugelassene Ultrahochfeld-MRT überhaupt und bietet eine neue klinische Feldstärke in der MR-Bildgebung. Nutzer in Europa können das System nun für die routinemäßige klinische Anwendung bei neurologischen und muskuloskeletalen Untersuchungen einsetzen. Die Entwicklung wurde am Exzellenzzentrum für Hochfeld-MR an der Medizinischen Universität Wien wissenschaftlich maßgeblich begleitet.
Die neue CE-Kennzeichnung besagt, dass das Produkt allen EU-Anforderungen hinsichtlich Sicherheit, klinischem Nutzen und Umweltschutz entspricht. „Mit der klinischen Zulassung erweitern wir – 15 Jahre nach der Etablierung der 3-Tesla-Scanner – die diagnostische MR-Bildgebung um eine neue Feldstärke, mit der wir einen neuen Detailgrad in Anatomie und Funktion erreichen können, um den weiteren Weg hin zur Präzisionsmedizin zu ebnen", so Christoph Zindel, Senior Vice President und Geschäftsführer Magnetresonanztomographie bei Siemens Healthineers.
Neue diagnostische Möglichkeiten bei Epilepsie und Multipler Sklerose
Magnetom Terra ermöglicht dank der sehr hohen räumlichen und spektralen Auflösung detailliertere Einblicke in den menschlichen Bewegungsapparat, zeigt präzise die metabolischen Prozesse im Gehirn und hilft zudem bei der Visualisierung neurologischer Krankheiten wie Alzheimer, Epilepsie und Multipler Sklerose (MS). Besonders deutlich werden die Vorteile der Ultrahochfeld-Bildgebung bei Gehirnuntersuchungen. Bei 7 Tesla sind Läsionen dank der besseren Auflösung und des stärkeren Bildkontrasts eindeutiger zu erkennen.
Ein Beispiel hierfür ist die Untersuchung von Epilepsie-PatientInnen, bei denen die bessere Unterscheidung zwischen weißer und grauer Gehirnsubstanz neue diagnostische Möglichkeiten bietet, die bei niedrigeren Feldstärken kaum möglich wären. Auch Menschen mit MS können von den 7-Tesla-Befunden durch die bessere Sichtbarkeit von Läsionen in der grauen Gehirnsubstanz, die zu kognitiven Einschränkungen führen können, profitieren. Aufgrund der Kombination von besserem Signal-Rausch-Verhältnis, stärkerem Gewebekontrast und höherer räumlicher Auflösung wird hier mit 7 Tesla sichtbar, was bei 3 Tesla nicht zu sehen ist.
"Die Fähigkeit, die 7-Tesla-Technologie im klinischen Bereich einsetzen zu dürfen, ist ein Durchbruch für eine breite klinische 7-Tesla-Anwendung. Die CE-Kennzeichnung wird zusätzlich unterstützt durch beachtliche Fortschritte bei neuen Hochfrequenz-Technologien und MR-Methoden, die Ganzkörperuntersuchungen mit 7 Tesla in Zukunft erst technisch möglich machen werden. Dies wird den Übergang vom Forschungsbereich in die klinische Anwendung stärken", sagt Siegfried Trattnig, Leiter des Exzellenzzentrums für Hochfeld-MR an der Medizinischen Universität Wien, "das höhere Signal-Rausch-Verhältnis, der verbesserte Kontrast und die nicht Protonen-basierte MR-Bildgebung bei 7 Tesla werden zu einer besseren räumlich-zeitlichen Auflösung führen, noch wichtiger aber zu einer verbesserten biochemischen und metabolischen Gewebecharakterisierung auf dem Weg zu einer klinischen nicht-invasiven personalisierten Medizin".
Dual-Mode-Funktionalität erlaubt Nutzung für Klinik und Forschung
Mit der Dual-Mode-Funktionalität des Magnetom Terra können Nutzer leicht zwischen den klinischen Protokollen und innovativen Forschungsmethoden wechseln. Dies macht das System zur idealen Plattform für die translationale Forschung und ermöglicht es, die Nutzung der 7-Tesla-Bildgebung zu erweitern, etwa für Ganzkörper-Anwendungen. Bisher wurde 7T für die Untersuchung und Verbesserung der Sichtbarkeit bei extrem kleinen Pathologien in der anatomischen Bildgebung, sowie für die subkortikalen Gehirnaktivitäten im Bereich der funktionalen Bildgebung eingesetzt. Zukünftig wird die Erkundung des Stoffwechsels im Patienten eine große Rolle spielen. Das 7-Tesla-System könnte dann als einer Art MR-Mikroskop verstanden werden, das die Anatomie, die Funktion und den Metabolismus von Körpergewebe untersucht. Für die Forschung besonders attraktiv ist die offene System-Architektur, die es den Anwendern ermöglicht, am Magnetom Terra eigene Entwicklungen zu nutzen und darauf aufzubauen.
Wichtiger Beitrag der MedUni Wien
Die Medizinische Universität Wien hat mit dem 7T im MR-Hochfeldzentrum die Entwicklung entscheidend beeinflusst, da hier der 7T schon sehr früh in klinischen Vergleichsstudien mit 3T eingesetzt wurde. „Während andere 7T-Zentren sich auf die Hardware-Entwicklung und vorwiegend auf neurologische Grundlagenforschung fokussiert haben, haben wir in Wien eine Reihe von klinischen Studien nicht nur im Neurobereich sondern in Ganzkörperanwendungen auf 7T (Gelenke, Leber, Nieren, weibliche Brust etc) durchgeführt“, erklärt Siegfried Trattnig, „Wien ist bezüglich klinischer Studien auf 7T die weltweit führende Site.“
Die Ergebnisse der Studien auf 7T, dokumentiert in einer Zahl von hochkarätigen Publikationen, hat Siemens veranlasst, einen eigenen 7T-Magneten herzustellen und ein klinisches 7T-MR zu entwickeln, das wie die Routine-MR-Geräte auf 1.5 und 3T eine CE Zertifizierung und die FDA Zulassung haben sollte, was nun geschehen ist.
Dafür wurden die Wiener Forscher von Siemens gebeten, zwei große Vergleichsstudien im Neuro- und Muskulo-Skeletalbereich durchzuführen, um zu zeigen, was 7T mehr als das klinische 3T MRT in klinischen Routinestudien zu leisten vermag. Die Ergebnisse dieser beiden Studien wurden in Topjournalen publiziert und dürften letzlich zum Erfolg bei der FDA und bei der CE-Zertifizierung geführt haben.
Comparison of Routine Brain Imaging at 3 T and 7 T.
Springer E, Dymerska B, Cardoso PL, Robinson SD, Weisstanner C, Wiest R, Schmitt B, Trattnig S.
Invest Radiol. 2016 Aug;51(8):469-82
Comparison of Routine Knee Magnetic Resonance Imaging at 3 T and 7 T.
Springer E, Bohndorf K, Juras V, Szomolanyi P, Zbýň Š, Schreiner MM, Schmitt B, Trattnig S.
Invest Radiol. 2017 Jan;52(1):42-54