
(Wien, 21-02-2017) Der Prozess der Vesikelfusion, auch genannt Membranfusion, dient Zellen zum Transport von diversen Stoffen wie Hormonen, Neurotransmittern und Abfall zu ihrem Bestimmungsort. WissenschaftlerInnen der Max F. Perutz Laboratories, einem Joint Venture der Universität Wien und der Medizinischen Universität Wien, in Kollaboration mit ForscherInnen der University of Pennsylvania berichteten nun ihre Entdeckung des Mechanismus des ersten, geschwindigkeitsbestimmenden Schrittes der Vesikelfusion in der Fachzeitschrift Nature Communications.
Vesikel sind kleine, flüssigkeitsgefüllte Strukturen, die von einer Lipiddoppelschicht umgeben sind. Aufgrund ihrer Rolle als Transportmittel von diversen zellulären Bestandteilen und Botenstoffen sowie zellulärem Abfall sind sie notwendig für die Aufrechterhaltung der zellulären Integrität. Um ihre Aufgaben zu erfüllen, müssen die Vesikel mit Zielmembranen von Organellen innerhalb der Zelle oder der Zellmembran verschmelzen, wodurch sie ihren Inhalt am gewünschten Ort abladen.
Der komplexe Mechanismus der Membranfusion wird durch Mitglieder der SNARE (Soluble NSF Attachment Protein Receptor) -Proteinfamilie, oft “SNARE-Komplex” genannt, ermöglicht. SNARE Proteine können, je nach Lokalisation, gegliedert werden in v-SNARES, die mit der Vesikelmembran assoziiert sind und t-SNARES, die in der Zielmembran zu finden sind.
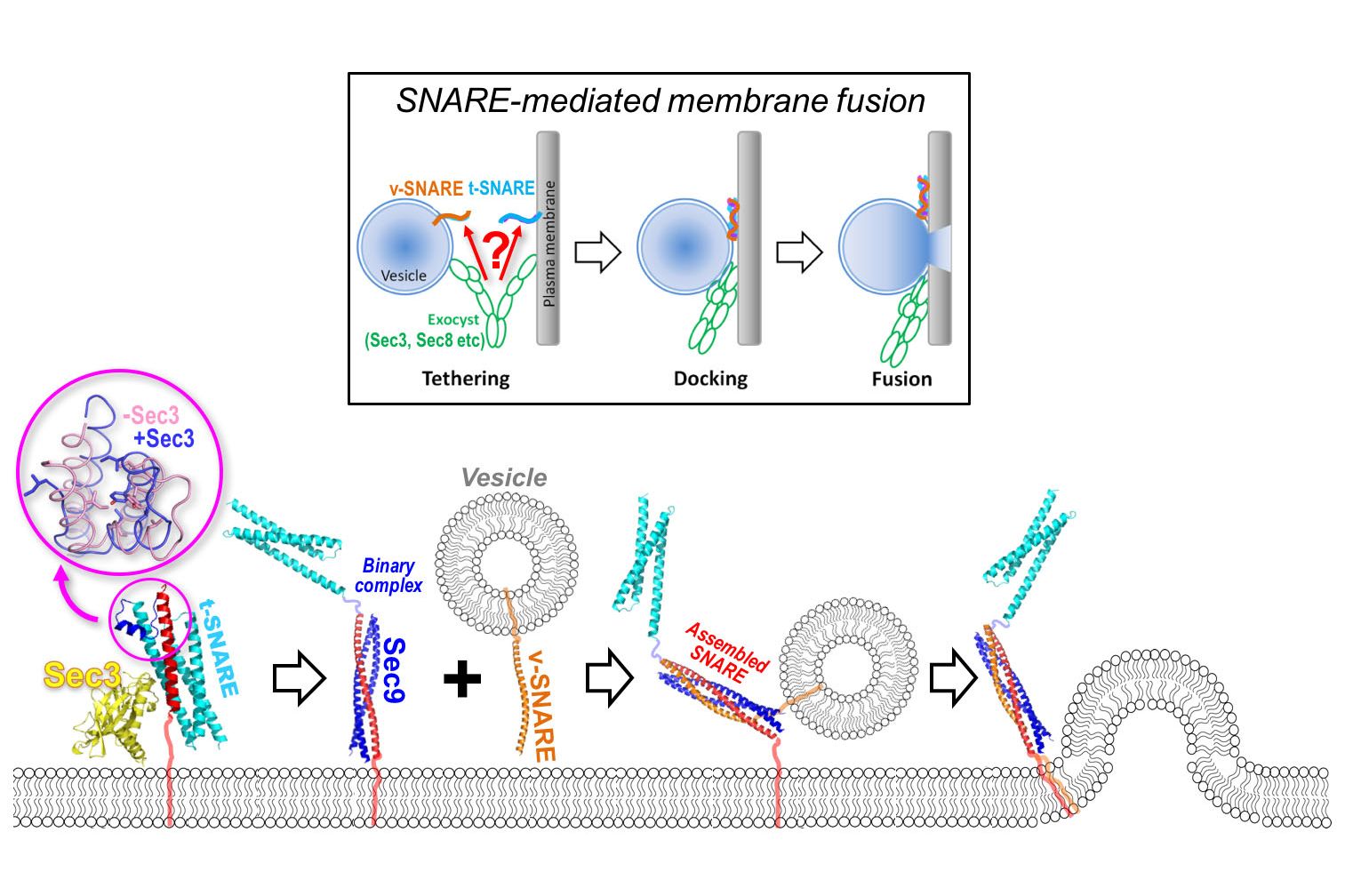
Während der Vesikelfusion fungiert der SNARE-Komplex als Reißverschluss, der die Vesikel- und Zielmembranen nahe genug zusammenführt, um ihr Verschmelzen zu ermöglichen. Die Details, wie dieser Prozess initiiert wird, blieben allerdings bis jetzt unbekannt.
Die Teams von Gang Dong vom Department für Strukturelle und Computerbasierte Biologie der MFPL und Wei Guo von der University of Pennsylvania berichteten nun den Mechanismus des ersten Schritts im Aufbau des SNARE Komplexes während der Vesikelfusion.
Um die SNARE-vermittelte Fusion zu ermöglichen, müssen Vesikel zuerst mithilfe des „Exocyst Complex“ an die Zellmembran andocken. Dieser Exocyst Complex besteht aus insgesamt acht Proteinen, darunter Sec3. Gang Dong und Team berichten nun erstmals, dass Sec3 direkt mit dem t-SNARE Protein Sso2 interagiert, ähnlich wie zwei Teile eines 3D Puzzles. Diese Interaktion verändert die Struktur von Sso2 und ermöglicht die weiteren Schritte der Membranfusion. „Obwohl zuvor bereits eine potentielle Rolle des Exocyst Complex im SNARE-Zusammenbau vermutet wurde, sind wir die ersten, die jene Komponente identifizieren konnten, die die SNARE-Komplex Bildung vorantreibt – den geschwindigkeitsbestimmenden Schritt im Prozess der Vesikelfusion. Außerdem konnten wir durch Ermittlung der Kristallstruktur eine mechanistische Erklärung dafür finden, wie so eine Aktivierung passiert.“, so Gang Dong.
Für Gang Dong ist die aktuelle Publikation ein gutes Beispiel für die Wichtigkeit von wissenschaftlichen Kollaborationen, denn die kombinierte Expertise von mehreren ForscherInnenn war essentiell für die Entdeckung dieses zuvor unbekannten Schrittes der Membranfusion. „Um die molekularen Mechanismen eines biologischen Prozesses zu entdecken, sollten strukturelle und funktionelle Studien meiner Meinung nach immer Hand in Hand gehen. Stephen Wainwright hat das am besten ausgedrückt: ‚Struktur ohne Funktion ist eine Leiche; Funktion ohne Struktur ist ein Geist. ‘ “
Defekte in der SNARE-vermittelten Vesikelfusion spielen eine Rolle in einer Reihe von neurodegenerativen Erkrankungen wie Parkinson, Chorea Huntington und Erkrankungen des Immunsystems. Informationen über die SNARE-vermittelte Membranfusion zu sammeln ist daher wesentlich für das bessere Verständnis der Krankheitsentstehung und die Entwicklung von potentiellen Therapieansätzen in der Zukunft.
Publikation in Nature Communications:
Peng Yue, Yubo Zhang, Kunrong Mei, Shaoxiao Wang, Johannes Lesigang, Yueyao Zhu, Gang Dong and Wei Guo: Sec3 promotes the initial binary t-SNARE complex assembly and membrane fusion. Nature Communications, DOI: 10.1038/ncomms14236