Dr. Ralph Gradisch

MedUni Wien RESEARCHER OF THE MONTH, Oktober 2025
Die Jury „Researcher of the Month” verleiht die Auszeichnung für diesen Monat Herrn Dr. Ralph Gradisch aus Anlass der im Top-Journal „Nature Communications“ (IF 15.7) erschienenen Arbeit „Ligand coupling mechanism of the human serotonin transporter differentiates substrates from inhibitors“ [1]. Die multidisziplinäre Studie entstand im Rahmen des PhD-Studiums von Dr. Ralph Gradisch am Institut für Pharmakologie in der Arbeitsgruppe von Assoc.-Prof. Dr. T. Stockner in Zusammenarbeit mit der Arbeitsgruppe von Univ.-Prof. Dr. H. Sitte (Institut für Pharmakologie), der Arbeitsgruppen von Univ.-Prof. Dr. Marko Mihovilovic (Technische Universität Wien, Institut für Angewandte Synthesechemie) und Prof. Dr. Randy D. Blakely (Florida Atlantic University, Department of Biomedical Science, Jupiter, FL, USA).
Neue Grundprinzipien des Serotonin Transporters – Physikochemische Unterscheidung von Substraten und Inhibitoren
Serotonin (5-hydroxytryptamin, 5-HT), wird in den Raphe Nuclei (zelluläre Strukturen im Hirnstamm), synthetisiert. Über organisierte und definierte serotonerge Neuronen wird 5-HT in verschiedenen Hirnarealen freigesetzt und beeinflusst somit unter anderem Emotionen, das Gedächtnis und soziale Interaktionen [2,3]. Durch präsynaptische elektrische Impulse, auch Aktionspotentiale genannt, wird 5-HT in den synaptischen Spalt ausgeschüttet. Das anschließende Binden von 5-HT an der Postsynapse ermöglicht somit eine synaptische Informationsweiterleitung. Ungleichgewichte, vor allem ein erniedrigter 5-HT Spiegel, werden mit Angststörungen und Depression, aber auch anderen neuroverhaltensbedingten Krankheiten assoziiert [4-6]. Arzneistoffe, welche selektiv die synaptische Serotoninkonzentration erhöhen, sind sogenannte selektive Serotonintransporter (SERT) Wiederaufnahme Hemmer, abgekürzt mit SSRI (engl. selective serotonin reuptake inhibitors). Psychopharmaka wie Escitalopram und Paroxetin, aber auch Rauschdrogen wie Kokain, binden SERT und blockieren folglich die Wiederaufnahme des physiologischen Substrates 5-HT [6]. Im Gegensatz zu Wiederaufnahmehemmern agieren viele illegale Suchtmittel wie Amphetamine und deren Derivate als SERT-Substrate. Sie können die Transportrichtung von SERT umkehren und somit 5-HT aus der Zelle „pumpen“ (daher „Releaser“ genannt) [7]. Beide obengenannten Mechanismen (Inhibition und Freisetzung) erhöhen das extrazelluläre 5-HT, was letztlich zu einem erhöhten serotonergen Informationsaustausch führt und Patient:innen mit depressiven Störungen helfen kann.
Im Gegensatz zu Ionenkanälen, welche eine offene Pore für den Substratdurchtritt in der Membran formen, bleibt bei Transportern das extra- und intrazelluläre Milieu getrennt. Als sekundär aktiver Transporter nutzt SERT den Natriumgradienten als Energiequelle und folgt einem Transportzyklus. Nach dem Binden von synaptischem (extrazellulärem) 5-HT ändert SERT seine Konformation (3D Struktur) und entlässt anschließend 5-HT in das intrazelluläre Milieu, um somit den Neurotransmitter vom synaptischen Spalt zu entfernen [6, 8]. Obwohl atomare 3D Cryo-EM Bilder von unterschiedlichen Konformationen vorhanden sind [9-11], waren das dynamische Verhalten von SERT sowie die physikochemischen Anforderungen von Substraten, Inhibitoren und Releasern weitestgehend unbekannt. In enger Zusammenarbeit mit internationalen Forschungsgruppen entschlüsselte unsere Forschungsgruppe durch die Synthese von 5-HT Analoga grundlegende Prinzipien der Botenstofferkennung und des Transportmechanismus von SERT. Darüber hinaus konnten die physikochemischen und räumlichen Voraussetzungen für die Differenzierung von Substraten und Inhibitor identifiziert werden.
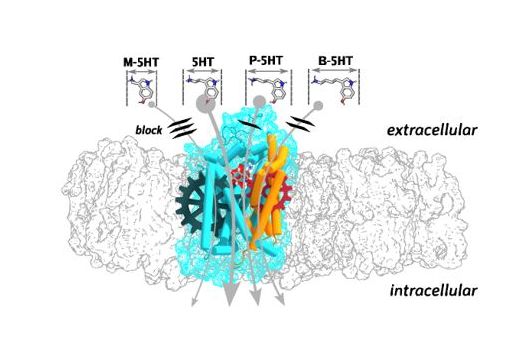
Molekulardynamik-Simulationen zeigen voraus, dass das physiologische Substrat 5-HT den Transportzyklus am stärksten induziert. Alle Derivative, welche eine verkürzte (Methylamin (M-5HT)) oder verlängerte (Propylamin (P-5HT) oder Butylamin (B-5HT)) Alkylamin-Gruppe unter Konstanthaltung der 5-hydroxyindol Struktur aufweisen (Abbildung), führen zu einer verminderten Transportrate von SERT. Erst in Präsenz eines Substrates mit optimaler Größe können die benötigen Kräfte zwischen dem Molekül und dem Protein aufgebaut werden, um den Transportzyklus zu initiieren. Obwohl beide Verlängerungen der Alkylamin-Seitenkette mit einem Affinitätsgewinn an SERT einhergehen, verhielten sich die modifizierten Derivate nun mehr als partielle Substrate im Vergleich zu 5-HT. Im Gegensatz dazu führt eine Verkürzung der Seitenkette zu einem Affinitätsverlust mit Eigenschaften, die einem Inhibitor entsprechen. Elektrophysiologische Messungen und Experimente mit Radioliganden verifizieren die Simulationsdaten.
Zusammenfassend kann gesagt werden, dass der Mechanismus des Substrattransportes wie das präzise Funktionieren eines Uhrwerks betrachtet werden kann. In Abwesenheit des Substrats fehlt ein essenzielles Zahnrad, welches das Getriebe zur vollen Funktion benötigt (Abbildung). Veränderungen an der Substratlänge beeinträchtigen die Funktion. Sowohl die räumliche Größe des Moleküls als auch seine physikochemische Interaktion mit dem Transporter definieren, ob ein Molekül als Substrat, partielles Substrat, Releaser oder Inhibitor agiert.
Abbildung. Darstellung eines Serotonintransporters (blau) eingebettet in einer Doppelmembran aus Phospholipiden (grau). Beide Strukturen sind als Oberflächen dargestellt. Der Serotonintransporter kann funktionell in zwei Einheiten unterteilt werden. Die dazugehörigen Transmembranhelices sind in blau und orange gefärbt. Serotonin und deren Analoga binden den Transporter von der extrazellulären Seite. Graue Pfeile zeigen die Transportrichtung sowie die Größe der Moleküle. Je dicker der Pfeil, desto höher die Transportrate des Moleküls.
Wissenschaftliches Umfeld
Dank des interdisziplinären wissenschaftlichen Umfelds, welches das PhD-Programm "Molecular Drug Targets (MolTag)“ geboten hat, konzentrierte sich die Forschung von Dr. Gradisch auf Transmembrantransporter und Ionenkanäle. Sein Interesse reicht von der atomaren Struktur bis hin zu Verhaltensphänotypen. In der Forschungsgruppe und Supervision von Assoc.-Prof. Dr. Thomas Stockner und in enger Zusammenarbeit mit Univ.-Prof. Dr. Harald Sitte erlernte er die Werkzeuge, um biophysikalische in silico Ansätze mit in vitro und ex vivo Experimenten zu verknüpfen. Diese Symbiose zweier Wissenschaftszweige bot neue Möglichkeiten zur Untersuchung des dynamischen Verhaltens von Proteinen und der Pharmakologie von Transmembranproteinen.
Internationale als auch nationale Zusammenarbeiten führten nicht nur zu zahlreichen Publikationen, sondern auch zu langfristigen Kollaborationen. Das Zusammenwirken mit der Technischen Universität (TU) Wien und der Florida Atlantic University entschlüsselte den Mechanismus der Ligandenkopplung mit dem Serotonin Transporter (SERT), sowie die molekularen Determinanten von Substraten und Inhibitoren, welche neue Möglichkeiten für rationale Ansätze der Medikamentenentwicklung schaffen. Mit dieser Studie gewann Dr. Gradisch auch den dritten Platz des Dora Brücke-Teleky Awards im Jahr 2024.
Durch das Mitwirken in einer Kollaboration mit der ETH Zürich gelang auch die erste hochauflösende Proteinstruktur eines Mitgliedes der Solute Carrier (SLC) 22 Familie – des organischen Kationentransporters (OCT) 3.
Im Zuge seiner wissenschaftlichen Tätigkeiten als Doktorand und der finanziellen Hilfsmittel von MolTag war es ihm erlaubt, an zahleichen internationalen Kongressen teilzunehmen, wo seine Forschung mit mehreren Preisen ausgezeichnet wurde. Im Jahr 2026 wird er als Chair des „Membrane Transport Proteins“ Gordon Research Seminars (GRS) fungieren.
Derzeit forscht Dr. Ralph Gradisch als Postdoktorand am Institut für Pharmakologie und Toxikologie der Universität Zürich in der Forschungsgruppe von Prof. Dr. Tommaso Patriarchi. Ziel der Forschung ist die Entwicklung von neuartigen genetisch-kodierten fluoreszierenden Neurotransmitter-Sensoren
Zur Person
Dr. Ralph Gradisch studierte von 2012 bis 2019 Pharmazie an der Universität Wien. Bereits während seiner Studienzeit engagierte er sich als Tutor im Bereich der Pharmakologie und Toxikologie. Neben seiner Studienzeit arbeitete er als wissenschaftlicher Mitarbeiter an der Veterinärmedizinischen Universität Wien, Institut für Pharmakologie und Toxikologie, im onkologischen Bereich. Direkt nach seinem Studienabschluss startete er sein Doktorat an der Medizinischen Universität Wien, wo er im internationalen Molecular Drug Targets (MolTag) PhD Programm eingeschrieben war. Im Rahmen seines PhD-Studiums beschäftigte er sich mit der Struktur und Funktion von Transmembranproteinen, wie Monoamintransportern, organischen Kationentransportern, aber auch Ionenkanälen.
Neben seinen Tätigkeiten als Doktorand, arbeitete Dr. Ralph Gradisch als Lektor an der Universität Wien und unterrichtete biochemische, mikrobiologische und vertiefende pharmazeutisch-chemische Arbeitstechniken.
Nach Abschluss seines PhDs im Oktober 2023, ist er seit Januar 2024 als Postdoktorand an der Universität Zürich, Institut für Pharmakologie und Toxikologie, Department für chemische Neuropharmakologie tätig und erhielt zudem das European Molecular Biology Organization (EMBO) postdoctoral fellowship.
Ausgewählte Literatur
-
Gradisch, R. et al. Ligand coupling mechanism of the human serotonin transporter differentiates substrates from inhibitors. Nat Commun 15, 417 (2024).
-
Berger, M., Gray, J. A. & Roth, B. L. The Expanded Biology of Serotonin. Annu. Rev. Med. 60, 355–366 (2009).
-
Masson, J., Emerit, M. B., Hamon, M. & Darmon, M. Serotonergic signaling: multiple effectors and pleiotropic effects. Wiley Interdiscip. Rev. Membr. Transp. Signal. 1, 685–713 (2012).
-
Murphy, D. L. Serotonin Transporter: Gene, Genetic Disorders, and Pharmacogenetics. Mol. Interv. 4, 109–123 (2004).
-
Lin, Z. & Madras, B. K. Human Genetics and Pharmacology of Neurotransmitter Transporters. in 327–371 (2006). doi:10.1007/3-540-29784-7_16.
-
Kristensen, A. S. et al. SLC6 neurotransmitter transporters: structure, function, and regulation. Pharmacol. Rev. 63, 585–640 (2011).
-
Sitte, H. H. & Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends Pharmacol. Sci. 36, 41–50 (2015).
-
Jardetzky, O. Simple Allosteric Model for Membrane Pumps. Nature 211, 969–970 (1966).
-
Coleman, J. A., Green, E. M. & Gouaux, E. X-ray structures and mechanism of the human serotonin transporter. Nature 532, 334–9 (2016).
-
Coleman, J. A. et al. Serotonin transporter-ibogaine complexes illuminate mechanisms of inhibition and transport. Nature 569, 141–145 (2019).
-
Yang, D. & Gouaux, E. Illumination of serotonin transporter mechanism and role of the allosteric site. Sci. Adv. 7, (2021).