Nach der Aktivierung werden Daten an YouTube übermittelt. Weitere Infos hier: Datenschutzerklärung
(Wien, Cambridge, 31-01-2020) Mit einem neuen bildgebenden Verfahren lässt sich in Echtzeit beobachten, welche Regionen eines Tumors aktiv sind. In Kombination mit genetischen Tests könnte dies bessere individuelle Therapien und eine frühere Abschätzung ihrer Wirksamkeit ermöglichen. Die erste Studie, die diese Technik verwendete um unterschiedliche Typen von Brustkrebs zu untersuchen wurde an der Universität Cambridge von ForscherInnen um die österreichische Medizinerin Ramona Woitek von der Universitätsklinik für Radiologie und Nuklearmedizin der MedUni Wien und Ferdia Gallagher, der auch Adjunct Professor der MedUni Wien ist, im Fachblatt "PNAS" veröffentlicht.
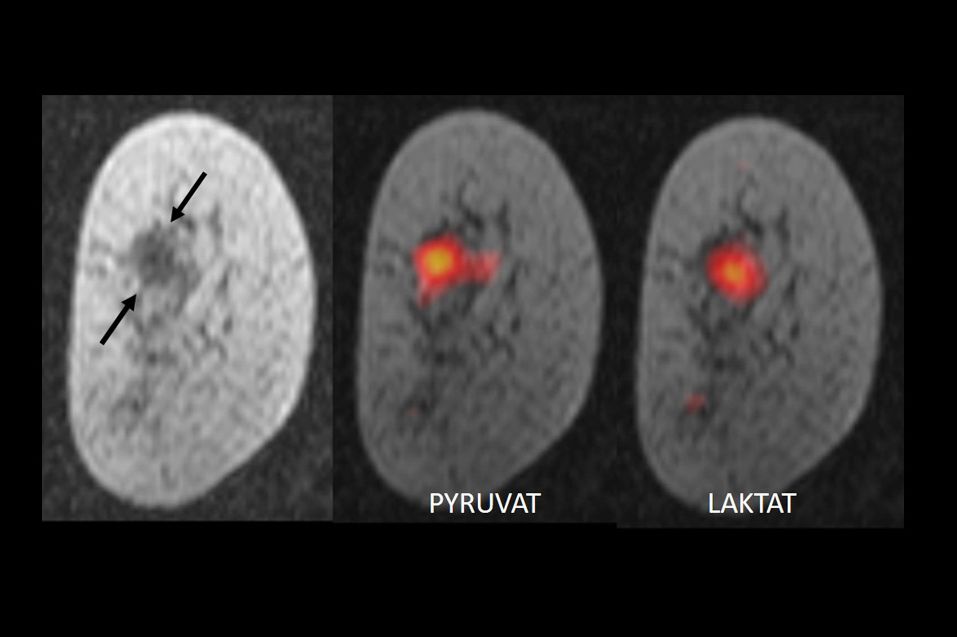
Grundlage des neuen bildgebenden Verfahrens ist die Magnetresonanztomographie (MRT). Diese liefert hoch aufgelöste Bilder von Organen und auch Tumoren, hat allerdings den Nachteil, nicht sehr empfindlich zu sein. Daher wird seit Jahren daran geforscht, die Empfindlichkeit der Methode zu verbessern. Dazu werden beispielsweise Substanzen, die nur in geringer Konzentration im Körper vorkommen, sichtbar gemacht, um Stoffwechselvorgänge in Echtzeit verfolgen können.
Die Gruppe an der Universität Cambridge hat die im Körper vorkommende Substanz Pyruvat mit dem nicht radioaktiven Kohlenstoffisotop C-13 markiert und diese magnetisiert. Dazu wird das markierte Pyruvat auf minus 272 Grad Celsius abgekühlt und einem sehr starken Magnetfeld und Mikrowellenstrahlung ausgesetzt – dieser Prozess wird auch "Hyperpolarisierung" genannt. Nachdem die Substanz wieder aufgetaut ist, wird sie Patientinnen injiziert. Durch die Magnetisierung erhöht sich die Signalstärke des C-13-Pyruvat im MRT um das 10.000-Fache, sodass innerhalb von Sekunden MRT Bilder des Tumorstoffwechsels angefertigt werden können. Üblicherweise wandeln Körperzellen Pyruvat in Laktat um. Da Tumorzellen einen veränderten Stoffwechsel aufweisen, erfolgt dort die Umwandlung von Pyruvat zu Laktat viel schneller – wobei die Geschwindigkeit des Prozesses zwischen verschiedenen Tumoren und auch innerhalb des Tumors variiert. Mit dem MRT lässt sich nicht nur die Menge des speziell behandelten Pyruvat in verschiedenen Geweben, sondern auch der Umwandlungsprozess in Echtzeit verfolgen. Die ForscherInnen zeigten, dass sich dadurch auf die Art des Tumors und dessen Aggressivität rückschließen lässt.
"Das ist eines der detailliertesten Bilder des Stoffwechsels von Brustkrebs, die wir je hatten. Es ist als ob wir den Tumor atmen sehen können", erklärt Kevin Brindle vom Cancer Research UK Cambridge Institute, einer der Begründer der Methode, in einer Aussendung.
Die ForscherInnen haben die Methode bisher bei sieben Patientinnen mit unterschiedlichen Brustkrebs-Tumoren angewendet und konnten dadurch Rückschlüsse auf die Aggressivität und Art des Tumors ziehen. Nun soll das Verfahren an einer größeren Gruppe erprobt werden und auch dazu eingesetzt werden, durch Veränderungen im Stoffwechsel früher als bisher Informationen über das Ansprechen einzelner Patientinnen auf deren Behandlung zu erhalten und so Patientinnen ermöglichen, so früh wie möglich die für sie ideale Therapie zu erhalten.
Service: PNAS
Imaging breast cancer using hyperpolarized carbon-13 MRI
Ferdia A. Gallagher, Ramona Woitek, Mary A. McLean, Andrew B. Gill, Raquel Manzano Garcia, Elena Provenzano, Frank Riemer, Joshua Kaggie, Anita Chhabra, Stephan Ursprung, James T. Grist, Charlie J. Daniels, Fulvio Zaccagna, Marie-Christine Laurent, Matthew Locke, Sarah Hilborne, Amy Frary, Turid Torheim, Chris Boursnell, Amy Schiller, Ilse Patterson, Rhys Slough, Bruno Carmo, Justine Kane, Heather Biggs, Emma Harrison, View ORCID ProfileSurrin S. Deen, Andrew Patterson, Titus Lanz, Zoya Kingsbury, Mark Ross, Bristi Basu, Richard Baird, David J. Lomas, Evis Sala, James Wason, Oscar M. Rueda, Suet-Feung Chin, Ian B. Wilkinson, Martin J. Graves, Jean E. Abraham, Fiona J. Gilbert, Carlos Caldas, and Kevin M. Brindle
PNAS first published January 21, 2020; https://doi.org/10.1073/pnas.1913841117